StressMarq Biosciences Inc.品牌商
10 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
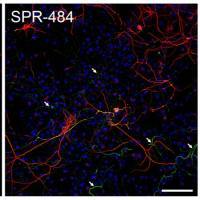
α-突触核蛋白活体注射建模全攻略
1206 人阅读发布时间:2022-04-14 00:45
该实验操作指南是将1 型小鼠PFFs (SPR-324) 或1 型人PFFs (SPR-322) 注射到大鼠脑中来产生alpha突触核蛋白病理特征。小鼠PFFs显示出了更强的聚集效果。 使用的动物: 雌性SD (Sprague Dawley) 大鼠 PFF和单体在注射之前需要超声处理。 16 ug PFFs 或者单体 (阴性对照) 通过以下两个脑顶叶区的位置注射 (每个注射位点16 ug):
第二天: (二抗, ABC 扩大信号, DAB 染色) -用 1X TBST (震荡,室温) 冲洗切片3次. 余下的步骤中,需要一直将切片保留在锡纸里,即使是冲洗的步骤。 -用含 5% 驴血清的 TBS 制备二抗溶液,稀释度为1:500。在冷室中培锡纸养盖好的切片2小时,震荡。 用 ______mL TBS, ______ uL 驴血清, _______ uL 生物素标记的驴抗兔 IgG -用 1X TBST (震荡,室温) 冲洗切片3次。 -用 ABC 试剂培养切片 30 分钟 (震荡, 冷室)。 -用 1X TBS 冲洗切片 3 次 (震荡,室温)。 -用 falcon 离心管和 ddH2O制备 DAB 溶液,每 5 mL H2O 加入如下溶液然后涡旋混合: 2 滴缓冲溶液 4 滴 DAB 溶液 2 滴H2O2溶液 *注意: 所有接触过DAB的器具只能用来操作DAB。我们还在通风橱内准备了一个DAB专用的废液缸。使用玻璃钩来处理DAB溶液中的切片而不能用漆刷,并且操作后要用漂白剂冲洗玻璃钩。盛装过DAB的器皿都需要用漂白剂冲洗并且处理到生物性危害箱中。* -用注射器过滤到新的6孔板中。每一个需要染色的脑切片都用一个新的DAB孔。 -在DAB中培养每个切片直到变为浅棕色 (2-3 分钟就足够; 时间太长可能会造成背景染色太多) -用 ddH2O 冲洗 3 次 -在 1X TBS 中封片,然后在切片柜中干燥过夜。
第三天: (脱水和盖玻片) *注意: 在开始脱水步骤之前,确保浸片用的玻璃皿里有足够的液体可以盖过切片上的所有组织。* -按照如下顺序和时间脱水切片: 1. 30 秒 ddH20 2. 3 分钟 70% EtOH 3. 3 分钟 95% EtOH 4. 3 分钟 95% EtOH 5. 3 分钟 100% EtOH 6. 3 分钟 100% EtOH *置于振荡器* 7. 5 分钟 Histoclear 8. 5 分钟 Histoclear 9. 5 分钟 Histoclear -将切片从切片篮从取出,一次一片,置于吸水纸上。 -加封片剂时,取一个P1000 移液器和吸头,将吸头尖剪掉,容量设到400到500 μL. -连续滴几滴封片剂 Permount 到切片的中间,倾斜切片使封片剂完全覆盖切片。 -用棉棒的木头一端赶出切片中的气泡。 -将切片放在吸水纸上,置于操作台上过夜晾干。 *注意: ~24 小时之后, 多余的Permount 封片剂应该用Histoclear移除*
- AP + 1.6, ML + 2.4, DV - 4.2
- AP - 1.4, ML + 0.2, DV - 2.8
- 1X TBS (含有和不含有 TX-100的)
- 30% H2O2
- 柠檬酸缓冲液
- 驴血清 (保存在 -20℃; 冻融稳定的)
- 一抗: SMC-600 Alpha Synuclein Antibody (pSer129)
- 二抗: 生物素-SP (long spacer) AffiniPure 驴抗兔 IgG (H+L) (Jackson Immuno; 货号: 711-065-152)
- ABC 试剂 (Vector; 货号: PK-7100)
- DAB 试剂 (Vector; 货号: SK-4100)
- 孔板 (规格取决于要染色的区域数量)
- 漆刷
- 玻璃钩
- 漂白剂
- ddH20
- BD Luer-lock 注射器 10 mL
- 过滤器 0.22 uM 孔径 (Fisher 货号. SLMP025SS)
- 100% EtOH
- Histoclear (用于清理组织)
- 显微镜载玻片和盖玻片
- Permount (封片剂)
第二天: (二抗, ABC 扩大信号, DAB 染色) -用 1X TBST (震荡,室温) 冲洗切片3次. 余下的步骤中,需要一直将切片保留在锡纸里,即使是冲洗的步骤。 -用含 5% 驴血清的 TBS 制备二抗溶液,稀释度为1:500。在冷室中培锡纸养盖好的切片2小时,震荡。 用 ______mL TBS, ______ uL 驴血清, _______ uL 生物素标记的驴抗兔 IgG -用 1X TBST (震荡,室温) 冲洗切片3次。 -用 ABC 试剂培养切片 30 分钟 (震荡, 冷室)。 -用 1X TBS 冲洗切片 3 次 (震荡,室温)。 -用 falcon 离心管和 ddH2O制备 DAB 溶液,每 5 mL H2O 加入如下溶液然后涡旋混合: 2 滴缓冲溶液 4 滴 DAB 溶液 2 滴H2O2溶液 *注意: 所有接触过DAB的器具只能用来操作DAB。我们还在通风橱内准备了一个DAB专用的废液缸。使用玻璃钩来处理DAB溶液中的切片而不能用漆刷,并且操作后要用漂白剂冲洗玻璃钩。盛装过DAB的器皿都需要用漂白剂冲洗并且处理到生物性危害箱中。* -用注射器过滤到新的6孔板中。每一个需要染色的脑切片都用一个新的DAB孔。 -在DAB中培养每个切片直到变为浅棕色 (2-3 分钟就足够; 时间太长可能会造成背景染色太多) -用 ddH2O 冲洗 3 次 -在 1X TBS 中封片,然后在切片柜中干燥过夜。
第三天: (脱水和盖玻片) *注意: 在开始脱水步骤之前,确保浸片用的玻璃皿里有足够的液体可以盖过切片上的所有组织。* -按照如下顺序和时间脱水切片: 1. 30 秒 ddH20 2. 3 分钟 70% EtOH 3. 3 分钟 95% EtOH 4. 3 分钟 95% EtOH 5. 3 分钟 100% EtOH 6. 3 分钟 100% EtOH *置于振荡器* 7. 5 分钟 Histoclear 8. 5 分钟 Histoclear 9. 5 分钟 Histoclear -将切片从切片篮从取出,一次一片,置于吸水纸上。 -加封片剂时,取一个P1000 移液器和吸头,将吸头尖剪掉,容量设到400到500 μL. -连续滴几滴封片剂 Permount 到切片的中间,倾斜切片使封片剂完全覆盖切片。 -用棉棒的木头一端赶出切片中的气泡。 -将切片放在吸水纸上,置于操作台上过夜晾干。 *注意: ~24 小时之后, 多余的Permount 封片剂应该用Histoclear移除*